Posidonia oceanica
| Posidonia oceanica | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Reino: | Plantae | |
| División: | Magnoliophyta | |
| Clase: | Liliopsida | |
| Orden: | Alismatales | |
| Familia: | Posidoniaceae | |
| Género: | Posidonia | |
| Especie: |
P. oceanica (L.) Delile, 1813 | |
| Distribución | ||
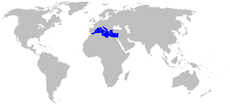 Distribución de Posidonia oceanica | ||
| Sinonimia | ||
| ||
Posidonia oceanica es una planta acuática, endémica del Mediterráneo, perteneciente a la familia Posidoniaceae. Tiene características similares a las plantas terrestres, como raíces, tallo rizomatoso y hojas cintiformes de hasta un metro de largo dispuestas en matas de 6 a 7. Florece en otoño y produce en primavera frutos flotantes conocidos vulgarmente como olivas de mar.
Forma praderas submarinas que tienen una notable importancia ecológica. Constituye la comunidad clímax del mar Mediterráneo y ejerce una considerable labor en la protección de la línea de costa de la erosión. Dentro de ellas viven muchos organismos animales y vegetales que encuentran en las praderas alimento y protección. Se la considera un buen bioindicador de la calidad de las aguas marinas costeras.[1]
Morfología
[editar]P. oceanica presenta raíces (que sirven principalmente para anclar la planta al sustrato), rizoma y hojas cintiformes.
Los rizomas, de hasta 1 cm de espesor, crecen tanto horizontalmente (rizomas plagiótropos), como verticalmente (rizomas ortótropos). Los primeros, gracias a la presencia en la parte inferior de raíces lignificadas de hasta 15 cm de largo, anclan la planta al sustrato. Los segundos, que aumentan la altura, tienen la función de combatir el enarenamiento debido a la continua sedimentación.[2] Los dos tipos de crecimiento dan lugar a la denominada "mata", una formación en terraza que consiste en un entramado de estratos de rizomas, raíces y sedimentos atrapados. De esta forma, las posidonias colonizan un entorno que difícilmente podrían ocupar las algas debido a la falta de raíces.

Las hojas surgen a partir de los rizomas ortótropos, son cintiformes y de color verde brillante que se vuelve marrón con el paso del tiempo. Pueden llegar a alcanzar una longitud de aproximadamente 1,5 m de alto. De promedio tienen una anchura de 1 cm y presentan de 13 a 17 nervaduras paralelas. Los ápices son redondeados y a menudo se pierden por la acción del oleaje y las corrientes.
Se organizan en matas de 6 o 7 hojas, encontrándose las más viejas en el exterior y las más jóvenes en el interior. Las hojas se dividen en tres categorías:
- Hojas adultas, que presentan una lámina con función fotosintética y una base separada del borde foliar por una estructura cóncava llamada "lígula";
- Hojas intermedias, que no tienen base;
- Hojas jóvenes, que normalmente tienen una longitud inferior a los 50 mm
En otoño la planta pierde las hojas adultas más exteriores, que pasan a ser de color marrón y son fotosintéticamente inactivas. Durante el invierno se producen las hojas nuevas.
Reproducción
[editar]
P. oceanica se reproduce tanto sexual como asexualmente (por estolones).[3]
La reproducción sexual se produce a través de la producción de flores y frutos. Las flores son hermafroditas y se agrupan en una inflorescencia en forma de espiga, de color verde y contenida entre brácteas florales. El pedúnculo se une al rizoma en el centro del manojo. El gineceo está formado por un ovario unilocular que continúa con un estilo y termina en el estigma. El androceo consta de tres estambres con anteras cortas. La floración depende de los factores ambientales (luz y temperatura) y los factores endógenos (edad y tamaño de la planta) y se lleva a cabo en septiembre y octubre en las praderas más cercanas a la superficie del mar, mientras que en las más profundas se pospone dos meses. El polen del interior de las anteras es de forma esférica, pero se convierte en filamentoso tan pronto como se libera en el agua.[4] No existen mecanismos de reconocimiento entre el polen y el estigma que impidan la autofecundación.[5] La polinización es hidrófila y puede dar lugar a la formación de frutos, aunque algunos de ellos no llegan a la maduración, que ocurre pasados seis meses. Una vez maduros, los frutos se separan y flotan en la superficie.
El fruto, ligeramente carnoso y llamado en algunos lugares "oliva de mar", es similar a una drupa y tiene un pericarpio poroso y rico en una sustancia oleosa que permite la flotación. Cuando se pudre libera una semilla (revestida por una membrana delgada, pero sin un tegumento verdadero y propio),[5] que cae al fondo y, si encuentra las condiciones adecuadas de profundidad, estabilidad y tipo de sedimento, germina y da lugar a una nueva planta. Con el fin de que pueda afianzarse es necesario que encuentre un sustrato humificado. La humificación consiste en la degradación de restos vegetales, por lo que la planta puede implantarse en "suelos" colonizados previamente por otras plantas, como macroalgas u otras fanerógamas. Se genera así una verdadera sucesión ecológica en la que la posidonia representa la última etapa. La germinación se inicia con la liberación de una pequeña raíz blanca de polo radical y una hojita del polo apical. Con la reproducción sexual, la planta coloniza zonas nuevas, difunde las praderas en otras áreas y garantiza la variabilidad genética.
La reproducción asexual por estolones, que permite la expansión de las praderas, se realiza mediante los rizomas plagiótropos, que crecen cerca de 7 cm al año y colonizan nuevos espacios. La alta acumulación de sedimentos y la reducción del espacio disponible para el crecimiento horizontal estimula el crecimiento vertical de los rizomas, formando así las matas.
Matas
[editar]
El crecimiento vertical de los rizomas lleva a la formación de una estructura llamada "mata", que consta de un entramado de raíces y rizomas muertos entre los cuales queda atrapado el sedimento. Sólo la parte superior de estas estructuras está formada por plantas vivas.[3] La formación de mata depende en gran medida de los ritmos de sedimentación (una alta velocidad de sedimentación puede dar lugar a un excesivo enarenamiento de los rizomas y por tanto a su asfixia; por el contrario, una sedimentación demasiado lenta puede conducir a que los rizomas se desprendan y, por tanto, a la regresión de la pradera).[6] Dado que la velocidad de descomposición de los rizomas es muy lenta, pueden permanecer dentro de la mata incluso durante milenios.[2]
La mata tiene una tasa de crecimiento muy lenta, estimada en alrededor de 1 m por siglo.[2]
Adaptación a la vida en el medio marino
[editar]Al igual que todas las fanerógamas marinas, la posidonia ha desarrollado una serie de adaptaciones morfológicas y fisiológicas que le permiten vivir en el mar.
En muchos órganos está presente el [parénquima] aerífero, que facilita el intercambio de gases en todas las partes de la planta y que forma una tupida red entre hojas, raíces y rizomas.
Las hojas no tienen estomas y tienen una cutícula delgada para facilitar la difusión de los iones y el dióxido de carbono. Las posidonias también son capaces de absorber los nutrientes por medio de las hojas.
A menudo, las plantas viven en un sustrato anóxico (falto de oxígeno). Por esta razón, las raíces, además de asegurar el anclaje y la absorción de los nutrientes, sirven como reserva de oxígeno, que es producido por la fotosíntesis de las hojas y transportado por el parénquima aerífero.
El organismo más grande del mundo
[editar]En 2006 se descubrió en las Baleares una planta de Posidonia de cerca de 8 km de largo, a la que se le atribuyó una edad de 100 000 años. La planta se sitúa en el interior de una pradera que se extiende unos 700 km² desde la zona de Es Freus (Formentera) hasta la playa de Las Salinas (Ibiza). La identificación de la planta fue posible gracias al uso de marcadores genéticos. El descubrimiento fue fortuito, ya que se estima que dentro de esta pradera viven cien millones de ejemplares de la misma especie. Se cree que esta planta es uno de los organismos vivos más grandes y longevos del mundo.[7]
La notable capacidad de la Posidonia para reproducirse asexualmente mediante rizomas le otorga la habilidad de expandirse de manera eficiente y colonizar nuevas áreas del fondo marino. Este proceso de expansión y colonización contribuye significativamente a su longevidad y estabilidad, permitiéndole formar extensas praderas submarinas que proporcionan un hábitat crucial para numerosas especies marinas. Además, esta capacidad de reproducción asexual asegura que la Posidonia pueda adaptarse y prosperar en diversos entornos marinos, manteniendo su presencia y función ecológica a lo largo del tiempo.
Es de destacar que en el año 1999, las praderas de posidonia que se encuentran entre las islas de Ibiza y Formentera, en la zona conocida como el parque natural de Ses Salines, fueron reconocidas como Patrimonio de la Humanidad por la Unesco bajo la denominación «Ibiza, biodiversidad y cultura». Este reconocimiento subraya la importancia ecológica y cultural de estas praderas submarinas, que son esenciales para la biodiversidad marina y la protección de las costas. (La Posidonia oceanica en Ibiza y Formentera).
Sin embargo, en junio de 2022 se informó que muestras de Posidonia australis tomadas de un prado en bahía Shark en el sur de Australia, de hasta 180 km, eran de un solo clon de la misma planta. Dicha planta cubre un área del lecho marino de alrededor de 200 km cuadrados, lo que la convertiría en la planta más grande del mundo.[8]
Evolución
[editar]Como todas las fanerógamas marinas, P. oceanica evolucionó de angiospermas que vivían en la zona intermareal, en la frontera entre la tierra y el mar, y que por lo tanto eran capaces de soportar breves períodos de inmersión en el agua. Cuando la polinización pasó de anemófila a hidrófila, las plantas abandonaron por completo la tierra firme. Los primeros fósiles de posidonia (P. cretacea) se remontan al Cretácico, hace unos 120 millones de años, mientras que en el Eoceno, hace 30 millones de años, hizo su aparición la P. parisiensis. La crisis salina del Mesiniense, que se produjo hace cerca de seis millones de años en el Mediterráneo, provocó una reducción de la variabilidad genética en la posidonia. Si bien antes existían tanto cepas capaces de vivir en condiciones locales de alta salinidad como cepas capaces de vivir en cuencas de baja salinidad, después de la crisis estas últimas desaparecieron y se seleccionaron solo aquellas capaces de vivir con una salinidad elevada. En el estanque de Marsala, las praderas se encontraban a una zona que podía llegar a unos valores de salinidad del 46-48‰.[9]
Taxonomía
[editar]Linneo, en su "Systema Naturae", describe la especie llamándola Zostera oceanica. En 1813 el estudioso Delile la renombró a Posidonia. El género Posidonia pertenece, según la mayoría de los botánicos, a la familia Posidoniaceae pero hay autores que la clasifican en Potamogetonaceae,[10] otros en Najadaceae[11] y otros incluso en Zosteraceae.[12] Incluso en lo que respecta al orden no hay acuerdo entre los estudiosos. De acuerdo con el sistema de Cronquist, Posidonia pertenece a Najadales, mientras que según el ITIS pertenece al orden Potamogetonales.[13] La clasificación APG mantiene su atribución a Posidoniaceae pero asigna la familia al orden Alismatales y considera sinónimos los dos órdenes citados anteriormente.[14]
El nombre genérico Posidonia deriva del griego Ποσειδών (Poseidón, el dios del mar), mientras que el epíteto específico oceanica hace referencia al hecho de que esta especie tenía una distribución mucho más amplia que la actual.
Distribución
[editar]
Esta especie se encuentra solo en el mar Mediterráneo. Ocupa un área de alrededor del 3 % de la cuenca (lo que corresponde a un área de aproximadamente 38 000 km²), siendo por tanto una especie clave del ecosistema marino costero.
Una señal inequívoca de la existencia de una pradera de Posidonia oceanica es la presencia de masas de hojas en descomposición en la playa, que tienen una gran importancia en la protección de las playas contra la erosión. De acuerdo con la Parte IV del Testo Unico Ambientale de Italia,[15] las hojas de posidonia en las playas son consideradas residuos sólidos y, por tanto, deben eliminarse. Según algunos, este material vegetal podría ser utilizado para el compostaje, pero esto está prohibido por el anexo 1C de la ley italiana 748/84,[16] que prohíbe el uso de "algas y plantas marinas" para la preparación de compost.[17]
En las playas, sobre todo en invierno, también se encuentran "bolas" marrones de fibras de Posidonia formadas por el oleaje.
Ecología
[editar]

Vive entre 1 y 30 m de profundidad, excepcionalmente y solo en aguas muy claras hasta los 40 m, y soporta temperaturas comprendidas entre los 10 y los 28 °C. Es una planta que necesita valores de salinidad relativamente constantes, por lo que difícilmente se encuentra cerca de la desembocadura de los ríos o en las lagunas. Como necesita una fuerte iluminación, la luz constituye uno de los principales factores limitantes. Coloniza los fondos arenosos o detríticos, a los cuales se adhiere a través de los rizomas y sobre los cuales forma grandes praderas, de alta densidad (más de 700 plantas por metro cuadrado). La producción primaria de las hojas de las praderas varía de 68 a 147 g C m–2 año–1, mientras que la producción de los rizomas oscila entre los 8,2 y los 18 g C m–2 año–1. Una pequeña parte de esta producción (del 3 al 10 %) es utilizada por los herbívoros, una parte más considerable pasa a los organismos descomponedores y otro porcentaje se almacena en el interior de las matas en hojas y rizomas.[18]
Las praderas presentan un límite superior y un límite inferior. El primero, el punto en que comienza la pradera partiendo de la costa, es bastante nítido, mientras que el segundo, el punto donde termina, puede ser de tres tipos:
- Límite progresivo o climático: a medida que aumenta la profundidad disminuye la densidad de los fascículos foliares, de manera que la luz se convierte en un factor limitante. Se caracteriza por la presencia de rizomas plagiótropos que finalizan de repente.
- Límite nítido o edáfico: el tipo de sustrato no permite la progresión de los rizomas, pasando por ejemplo de un sustrato arenoso a otro rocoso. Se caracteriza por la ausencia de mata' y la presencia de una alta densidad de fascículos foliares.
- Límite erosivo: está vinculado a un fuerte hidrodinamismo que no permite que la pradera avance.[19] Se caracteriza por una elevada densidad y presencia de matas.
- Límite regresivo: es causado por la contaminación, que hace que las aguas se vuelvan turbias en una determinada zona, impidiendo por tanto que la luz penetre a más profundidad. Solo se encuentran matas muertas.
En áreas resguardadas y de bajo hidrodinamismo, que provoca el aumento de la sedimentación, las matas pueden aumentar hasta crear una barrera llamada arrecife barrera. Entre la barrera y el litoral se puede formar una laguna, que impide el progreso de la pradera hacia la costa. El arrecife barrera desempeña un papel importantísimo en la protección de la línea costera contra la erosión.
En cambio, en las zonas de alto hidrodinamismo los rizomas puede ser arrancados, creando unas formaciones llamadas intermatas, constituidas por los canales de erosión.
Comunidades asociadas a Posidonia oceanica
[editar]Las características propias de la planta Posidonia, su dinámica de crecimiento y la gran cantidad de biomasa producida, son factores que pueden sostener comunidades de plantas y animales muy diversas. Se distinguen: comunidades epifitas (es decir, bacterias, algas y briozoos que colonizan la superficie de las hojas y los rizomas de la planta), comunidades animales vágiles y sésiles y comunidades de organismos detritívoros.
Comunidades epifitas
[editar]
A lo largo de la hoja se pueden identificar sucesiones y zonaciones que siguen la edad de la misma. Cerca de la base de la hoja y sobre las hojas jóvenes, se implantan diatomeas y bacterias. Sucesivamente, en la parte central se implantan algas rojas y marrones incrustantes, mientras que por encima de las incrustantes y en la zona apical viven algas erectas filamentosas.
Las comunidades epifitas son consumidas por moluscos gasterópodos, crustáceos anfípodos y poliquetos, y desempeñan un papel muy importante en la cadena alimentaria de las praderas de Posidonia, teniendo en cuenta el hecho de que son pocos los organismos que son capaces de nutrirse directamente del tejido vegetal de la planta, poco apetecible para los herbívoros debido al alto porcentaje de carbohidratos estructurales, a los elevados valores de carbono y nitrógeno y a la presencia de compuestos fenólicos. Las epifitas, sin embargo, también pueden dañar a la planta. De hecho, al aumentar cada vez más el peso, pueden provocar la caída prematura de las hojas, disminuyen la luz y también obstaculizan los intercambios gaseosos y la absorción de nutrientes a través de las hojas.
Comunidades animales y detritívoras
[editar]

La fauna asociada a las praderas de Posidonia se compone de animales sésiles, que viven adheridos al sustrato de hojas y rizomas, y de animales vágiles, capaces de moverse dentro de la pradera. También están los organismos que viven en el interior de las matas y que son principalmente detritívoros. Estudios realizados por Gambi et al. en 1992[20] han revelado que aproximadamente el 70 % de la población animal total de la pradera se compone de herbívoros. Entre estos, los más abundantes son los equinodermos, en particular el erizo Paracentrotus lividus, uno de los pocos organismos que pueden alimentarse directamente de las hojas de la planta. Los carnívoros tienen su representación en peces, moluscos, poliquetos y decápodos.
Entre los moluscos, un habitante habitual y casi exclusivo de las praderas es Pinna nobilis, el mayor bivalvo del Mediterráneo y fuertemente amenazado por la pesca de los coleccionistas y la contaminación.[21]
La población de peces se compone de un pequeño número de especies, principalmente lábridos y espáridos, casi todos carnívoros.
Son poco frecuentes los peces de grandes dimensiones y durante el curso del año se registran variaciones de la abundancia específica debido a los reclutamientos y las migraciones. En las praderas superficiales hay una gran abundancia del herbívoro Sarpa salpa, que representa el 40-70 % de la fauna íctica estival.[22]
Los restos de las hojas caídas son colonizados por microorganismos y hongos. Un grupo particular de detritívoros son los poliquetos (Lysidice ninetta, Lysidice collaris y Nematonereis unicornis) y los isópodos (Idotea hectica, Limnoria mazzellae), que para alimentarse y ampliar su propio hábitat excavan galerías dentro de los restos de las bases de las hojas, que permanecen unidas al rizoma durante años.[23][24]
Las hojas, degradadas por las olas y los microorganismos, una vez llegan a la playa, sirven de refugio y alimento a insectos, anfípodos e isópodos.
Fitosociología
[editar]Desde el punto de vista fitosociológico, P. oceanica representa la especie característica de la asociación Posidonietum oceanicae (Molinier, 1958). Esta asociación es característica de los fondos arenosos y fangosos del plano infralitoral y en su interior se distinguen diferentes agrupaciones dependientes: en los rizomas se encuentra la biocenosis constituida por la asociación Flabellio-Peyssonnelietum squamariae (Molinier, 1958), mientras que en las hojas de la planta se distingue la asociación epifita Myrionemo-Giraudietum sphacelarioidis (Van der Ben, 1971). Esta agrupación no es exclusiva de las praderas de Posidonia, también se encuentra en las hojas de otras angiospermas marinas y en especies del género Cystoseira.[25]
Importancia del ecosistema
[editar]La pradera de posidonia constituye la "comunidad clímax" del Mediterráneo, que representa el máximo nivel de desarrollo y complejidad que un ecosistema puede alcanzar. Se trata, por tanto, de uno de los ecosistemas más importantes del mar Mediterráneo, por lo que ha sido clasificado como "hábitat prioritario" en el anexo I de la Directiva Hábitat (Dir. n º 92/43/CEE), una ley que reúne todos los Lugares de Importancia Comunitaria (LIC) que necesitan ser protegidos.[26]

En el ecosistema costero, la posidonia desempeña un papel fundamental por varias razones:
- gracias a su desarrollo foliar libera al ambiente hasta 20 litros de oxígeno por día y por m² de pradera;[27]
- produce y exporta biomasa tanto en los ecosistemas vecinos como en profundidad;
- proporciona refugio y es zona de reproducción para muchos peces, cefalópodos, bivalvos, gasterópodos, equinodermos y tunicados;
- consolida los fondos de las costas y ayuda a contrarrestar un excesivo transporte de sedimentos debido a las corrientes costeras;
- actúa como barrera, atenuando la fuerza de las corrientes y las olas[28] y previniendo por tanto la erosión costera;
- la amortiguación del oleaje llevada a cabo por el estrato de hojas muertas en las playas las protege de la erosión, especialmente durante el período de tormentas invernales.
En todo el Mediterráneo las praderas de posidonia están en regresión,[29] un fenómeno que ha ido aumentando en los últimos años con el incremento de la presión antrópica sobre el litoral.
La desaparición de las praderas tiene efectos negativos no solo en el ecosistema de la posidonia sino también en otros ecosistemas, basta pensar que la pérdida de un solo metro lineal de pradera puede conducir a la desaparición de varios metros de playa, debido a los fenómenos erosivos.[3] Además, la regresión de las praderas comporta una pérdida de biodiversidad y un deterioro de la calidad del agua.

Las causas de esta regresión se pueden encontrar en:
- contaminación: la posidonia es muy sensible a los agentes contaminantes;
- pesca de arrastre;[30]
- práctica de deportes náuticos (daños debidos a las anclas, derrames de hidrocarburos, detergentes, pinturas, residuos sólidos, etc.);[31]
- construcción de obras costeras, que implican la instalación de desagües que liberan las aguas residuales al mar, aumentando la turbidez del agua y dificultando la fotosíntesis;[32]
- construcción de diques y otras barreras que modifican la tasa de sedimentación en el mar;[33]
- eutrofización de las aguas costeras, que causa un crecimiento anormal de algas epifitas, obstaculizando así la fotosíntesis.[34]
Recientemente, las praderas también se ven amenazadas por la competencia de dos algas tropicales liberadas accidentalmente en el Mediterráneo, Caulerpa taxifolia[35] y Caulerpa racemosa.[36] Ambas especies tienen un crecimiento rápido y están suplantando poco a poco a la posidonia.
Posidonia oceanica como bioindicador
[editar]Posidonia se viene utilizando desde hace unos veinte años como indicador biológico.[37] De hecho, la planta presenta todas las características propias de un buen bioindicador:

- es una especie bentónica;
- presenta un largo ciclo de vida;
- está ampliamente extendida por todo el Mediterráneo;
- tiene una gran capacidad de concentración de sustancias contaminantes en sus tejidos;
- es muy sensible a los cambios ambientales.
Por tanto, a través del estudio de las praderas es posible conocer con bastante fiabilidad la calidad ambiental de las aguas marinas costeras.
Por lo general, los métodos de estudio de las praderas de Posidonia son cuatro:
- análisis y seguimiento del límite inferior;
- análisis de la densidad de las praderas;
- análisis fenológico;
- análisis lepidocronológico.
Análisis del límite inferior
[editar]Existe una estrecha relación entre la profundidad del límite inferior y la transparencia del agua. Sobre esta base, se ha propuesto una tabla que relaciona las dos variables (Tabla 1) y que puede aplicarse a todo tipo de límite inferior, salvo el erosivo en tanto que condicionado por el hidrodinamismo del fondo.[38]
| Profundidad del límite inferior (m) | Transparencia del agua |
|---|---|
| de 0 a -15 | Baja transparencia |
| de -15 a -25 | Poca transparencia |
| de -25 a -35 | Transparencia |
| inferior a -35 | Transparencia elevada |
Densidad de los fascículos foliares
[editar]Por lo que respecta a la densidad, depende de la profundidad a la que se encuentra la pradera, de la intensidad luminosa y del tipo de sustrato. Según la densidad de los fascículos foliares, medida en n.º de matas/m², las praderas se dividen en 5 clases (Tabla 2).[39]
| Clase | Densidad de las matas | Estimación de densidad |
|---|---|---|
| I | más de 700 matas/m² | Pradera muy densa |
| II | de 400 a 700 matas/m² | Pradera densa |
| III | de 300 a 400 matas/m² | Pradera poco densa |
| IV | de 150 a 300 matas/m² | Pradera muy poco densa |
| V | de 50 a 150 matas/m² | Semipradera |
Pergent en 1995[40] y Pergent-Martini en 1996[41] propusieron otra clasificación que relaciona la densidad de matas con la profundidad, encontrando así 4 clases de densidad. Por tanto, es posible identificar tres tipos de praderas:
- praderas en equilibrio: la densidad es normal o excepcional;
- praderas alteradas: la densidad es baja;
- praderas muy alteradas: la densidad es anormal.
También en este caso se realizó una tabla (tab. 3).
| Profundidad (m) | Pradera muy alterada | Pradera alterada | Pradera en equilibrio | |
|---|---|---|---|---|
| Densidad anormal (matas/m²) | Densidad baja (matas/m²) | Densidad normal (matas/m²) | Densidad excepcional (matas/m²) | |
| 20 | Menos de 61 | Entre 61 y 173 | Entre 173 y 397 | Más de 397 |
| 21 | Menos de 48 | Entre 48 y 160 | Entre 160 y 384 | Más de 384 |
| 22 | Menos de 37 | Entre 37 y 149 | Entre 149 y 373 | Más de 373 |
| 23 | Menos de 25 | Entre 25 y 137 | Entre 137 y 361 | Más de 361 |
| 24 | Menos de 14 | Entre 14 y 126 | Entre 126 y 350 | Más de 350 |
| 25 | Menos de 4 | Entre 4 y 116 | Entre 116 y 340 | Más de 340 |
| 26 | Menos de 106 | Entre 106 y 330 | Más de 330 | |
| 27 | Menos de 96 | Entre 96 y 320 | Más de 320 | |
| 28 | Menos de 87 | Entre 87 y 311 | Más de 311 | |
| 29 | Menos de 78 | Entre 78 y 302 | Más de 302 | |
| 30 | Menos de 70 | Entre 70 y 294 | Más de 294 | |
Análisis fenológicos
[editar]Los análisis fenológicos permiten estudiar diferentes parámetros útiles para describir el estado de salud de las plantas:
- número medio de hojas por edad (adultas, intermedias, jóvenes), por fascículo foliar;
- longitud y anchura media de las hojas por edad y fascículo foliar;
- porcentaje de tejido marrón: representa el % de hojas adultas que presentan tejido no fotosintetizante;
- índice LAI (Leaf Area Index): mide la superficie foliar por m² de pradera;
- coeficiente "A": porcentaje de hojas que han perdido el ápice.
Análisis lepidocronológicos
[editar]El análisis lepidocronológico consiste en el estudio de los ciclos de vida de las hojas de P. oceanica, que en el momento de su separación, una vez muertas, dejan sobre el rizoma de la planta la parte basal. Estos residuos, que con el tiempo pasan a convertirse en astillas, tienen grosores variables con tendencias cíclicas anuales, útiles para el estudio de las variables ambientales.[42] Sus objetivos pueden resumirse como sigue:
- estimar la biomasa producida al año, tanto en términos de alargamiento de los rizomas, como en producción de hojas;
- estimar la producción de flores y, por tanto, estimar información sobre el número de fenómenos de reproducción sexual producidos a lo largo de los años;
- medir la concentración de metales pesados en los tejidos de la planta.
Usos
[editar]En el pasado, las hojas se utilizaban como aislante en la construcción de techos, como cama para el ganado o para embalar materiales frágiles, de hecho se la llama "alga de vidrieros".[43] En farmacología las hojas se usan para tratar la inflamación y la irritación. En algunas zonas del Mediterráneo aún se usan las hojas para la alimentación del ganado. Actualmente se está analizando la posibilidad de utilizarla para la producción de biogás.[44]
Iniciativas para su conservación
[editar]Patrimonio de la humanidad
[editar]En 1999 las praderas de posidonia existentes entre las islas de Ibiza y Formentera, en la zona llamada parque natural de las Salinas fueron declaradas Patrimonio de la Humanidad por la Unesco dentro de la denominación «Ibiza, biodiversidad y cultura».[45]
Apps para visualizar y proteger las praderas de posidonia
[editar]Desde 2021 existen varias apps para teléfonos móviles que tienen por objetivo la protección de las praderas de posidonia. Estas apps indican al usuario la situación cartográfica de las praderas de posidonia para que las embarcaciones de recreo puedan evitar fondear sobre ella, así como ofrecen otras recomendaciones para el fondeo. Una de las apps es Posidonia App creada por el Gobierno de las Islas Baleares. Esta, además de indicar donde se puede fondear o no, permite resolver dudas sobre la posidonia, dar aviso de posibles daños en las praderas y mandar propuestas e ideas. Esta iniciativa está ligada al "Teléfono Posidonia", específico sólo para atender las llamadas sobre esta planta.[46] También la Generalidad de Cataluña ha creado una app para la protección de esta fanerógama clave en la costa catalana: App FanCat en la forma de una capa descargable desde la aplicación Carry Map.[47] Estas iniciativas tienen por objetivo involucrar a la ciudadanía en la protección de las praderas de posidonia e implicar al sector de la navegación en su conservación.
Véase también
[editar]Notas
[editar]- ↑ Santiago Campillo. «Un bosque en el mar.» Journal of Feelsynapsis (JoF). ISSN 2254-3651. 2012.(2): 26-33.
- ↑ a b c Boudouresque et al., 1984.
- ↑ a b c Mazzella et al., 1987.
- ↑ Clifford, H. T.; et al. (1985). The Families of the Monocotyledons: Structure, Evolution, and Taxonomy. Springer. pp. 316. ISBN 3-540-43039-3.
- ↑ a b Klaus Kubitzki, ed. (1990). Flowering Plants. Monocotyledons, volume 4. Springer. p. 405. ISBN 3-540-64061-4.
- ↑ Boudouresque y Meinesz, 1982, op. cit.
- ↑ «Descubren en las aguas de Formentera el organismo más grande del mundo, una alga de 8 kilómetros». Biología Marina. Nuestra Tierra - supl. en "La Verdad". 16 de junio de 2006. Archivado desde el original el 25 de mayo de 2007. Consultado el 4 de octubre de 2007.
- ↑ Readfearn, Graham (1 de junio de 2022). «Scientists discover 'biggest plant on Earth' off Western Australian coast». The Guardian. Consultado el 1 de junio de 2022.
- ↑ Calvo, S.; et al.. «Stagnone di Marsala, Sicily - Italy» (PDF). Consultado el 5 de octubre de 2007.
- ↑ «Posidonia K.D. Koenig». Archivado desde el original el 6 de septiembre de 2017. Consultado el 8 de octubre de 2007.
- ↑ «GBIF Portal». Consultado el 8 de octubre de 2007. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Cognetti, G.; M. Sarà; G. Magazzù (2004). «Gli organismi del benthos». Biologia marina (2ª reimpresión de la 1ª edición edición). Bolonia: Il Sole 24 Ore Edagricole. pp. 254-255. ISBN 88-506-2720-3.
- ↑ Bisby, F. A. et al. (2007). «Posidonia oceanica (Linnaeus) Delile». Species 2000 & ITIS Catalogue of Life: 2007 Annual Checklist (en inglés). Reading, R.U.: Species 2000. Archivado desde el original
|urlarchivo=requiere|url=(ayuda) el 6 de septiembre de 2009. Consultado el 10 de agosto de 2007. - ↑ «Angiosperm Phylogeny Website» (en inglés). Consultado el 8 de octubre de 2007.
- ↑ D. Lgs. 152/2006
- ↑ L. 19 de octubre de 1984, n. 748, en materia de "Nuove Norme per la Disciplina dei Fertilizzanti"
- ↑ Massimo Centemero, «Se la posidonia à compostabile.» La Nuova Ecologia, 2005.
- ↑ G. Pergent; et al. (diciembre de 1997). «Fate of primary production in Posidonia oceanica meadows of the Mediterranean». Aquatic Botany 59 (3-4): 307-321. doi:10.1016/S0304-3770(97)00052-1. ISSN 0304-3770.
- ↑ Infantes, Eduardo; Terrados, J., Orfila, A., Cañellas, B., Álvarez-Ellacuaria, A. (Nov de 2009). «Wave energy and the upper depth limit distribution of Posidonia oceanica». Botanica marina 52: 419-427. doi:10.1515/BOT.2009.050. Consultado el 17 de marzo de 2014.
- ↑ Gambi, M. C.; et al. (1992). «Depth and seasonal distribution of some groups of the vagile fauna of the Posidonia oceanica leaf stratum: structural and trophic analyses». P.S.Z.N. I: Marine Ecology 13 (1): 17-39. ISSN 0173-9565.
- ↑ «Pinna nobilis». Ministero dell'Ambiente e della Tutela del Mare. Consultado el 16 de octubre de 2007.
- ↑ Francour, P. (1997). «Fish assemblages of Posidonia oceanica beds at Port-Cros (France, NW Mediterranean): Assessment of composition and long-term fluctuations by visual census». Marine ecology 18 (2): 157-173. ISSN 0173-9565.|Abstract Archivado el 4 de mayo de 2008 en Wayback Machine.
- ↑ M.C., Gambi; et al. (1997). «Borers in Posidonia oceanica scales: taxonomical composition and occurence». Biologia Marina Mediterranea 4 (1): 253-261, 384-387. ISSN 1123-4245.
- ↑ Di Maida, G.; et al. (septiembre de 2003). «Distribuzione dei borers nelle praterie di Posidonia oceanica (L.) Delile della Sicilia» (PDF). En Casagrandi, R.; Melià, P., ed. Ecologia quantitativa: metodi sperimentali, modelli teorici, applicazioni. Atti del XIII Congresso Nazionale della Società Italiana di Ecologia. Roma: Aracne. ISBN 88-7999-767-X.
- ↑ Giaccone, Giuseppe; Vincenzo Di Martino. «La vegetazione ad Angiosperme marine». Dip. Bot. Università degli Studi di Catania. Archivado desde el original el 25 de agosto de 2007. Consultado el 9 de octubre de 2007.
- ↑ «Direttiva n° 92/43/CEE» (PDF). Archivado desde el original el 13 de abril de 2007. Consultado el 4 de octubre de 2007.
- ↑ Boudoresque & Meinesz (1982), op. cit.|urlarchivo=http://web.archive.org/web/http://www2.minambiente.it/sito/settori_azione/scn/legislazione/direttive/docs/direttivacee_21_05_92.pdf%7Cfechaarchivo=27 de noviembre de 2015
- ↑ Infantes, Eduardo; Orfila, A.; Simarro, G.; Terrados, J.; Luhar, M.; Nepf, H. (junio de 2012). «Effect of a seagrass (Posidonia oceanica) meadow on wave propagation». Marine Ecology Progress Series 456: 63-72. doi:10.3354/meps09754. Consultado el 9 de marzo de 2014.
- ↑ Peres, J. M. (1984). «La regression des herbiers à Posidonia oceanica». En C. F. Boudouresque; A. Jeudy de Grissac ; J. Olivier;, ed. International Workshop on Posidonia oceanica beds (en francés). GIS Posidonie publ. pp. 445-454. ISBN 2-905540-00-1.
- ↑ Ardizzone, G. D.; Pelusi P. «Regression of a Tyrrhenian Posidonia oceanica praire exposed to nearshore trawling». Rapport et Prôcess verbeaux de Réunion CIESM 28 (3): 175-177. ISSN 0373-434X.
- ↑ Milazzo, M.; et al. (2002). «Effetti degli ancoraggi sulla prateria a Posidonia oceanica della Riserva marina isola di Ustica: Dati preliminari». Biol. mar. Medit. 9 (1): 686-689. ISSN 1123-4245.
- ↑ Balestra Elena; et al. (2004). «Variability in patterns of growth and morphology of Posidonia oceanica exposed to urban and industrial wastes: contrasts with two reference locations». Journal of Experimental Marine Biology and Ecology 308 (1): 1-21. doi:10.1016/j.jembe.2004.01.015. ISSN 0022-0981.
- ↑ Blanc J.J. (1985). «Ruptures d'équilibre au littoral de la Provence occidentale, l'action des tempêtes, relations avec les aménagements littoraux sur les equilibries sedimentaires, et en particulier sur l'herbier a Posidonia oceanica». Tethys 11 (3 y 4): 350 y 329. ISSN 0040-4012.
- ↑ Burkholdera Joann M.; et al (2007). «Seagrasses and eutrophication». Journal of Experimental Marine Biology and Ecology 350 (1-2): 46-72. doi:10.1016/j.jembe.2007.06.024. ISSN 0022-0981.
- ↑ De Villele, X.; Verlaque, M. (1995). «Changes and degradation in a Posidonia oceanica bed invaded by introduced tropical alga Caulerpa taxifolia in the North Western Mediterranean». Bot. Mar. 38 (1): 79-87. ISSN 0006-8055.
- ↑ Ceccherelli, G.; et al. (2000). «Response of the non-indigenous Caulerpa racemosa (Forsskal) J. Agardh tho the native seagrass Posidonia oceanica (L.) Delile: effect of density of shoots and orientation of edges of meadows». Journal of experimental marine biology and ecology 243: 227-240. doi:10.1016/S0022-0981(99)00122-7. ISSN 0022-0981.
- ↑ Pergent (1995) op. cit., pág. 4.
- ↑ Pergent (1995), op. cit., pág. 5.
- ↑ Giraud, G. (1977). «Contribution à la description et à la phènologie des herbiers à Posidonia oceanica (L.) Delile». Thèse Doctorat 3ème Cycle, Univ. Aix-Marseille II: 150.
- ↑ Pergent et al op. cit.
- ↑ Pergent-Martini, C.; G. Pergent (1996). «Spatio-temporal dynamics of posidonia oceanica beds near a sewage outfall (Mediterranean–France)». En J. Kuo et al., ed. Seagrass Biology: Proceedings of an international workshop. Rottnest island: The University of Western Australia. pp. 229-306. ISBN 0-86422-445-1.
- ↑ Dolce, Tania; Eugenio Fresi, Stanislao Ziantoni (Dipartimento di Biologia, Università Tor Vergata, Roma), Michele Scardi (Stazione Zoologica A. Dohrn,Napoli) (22 de septiembre de 2000). «Studio lepidocronologico di Posidonia oceanica (L.) Delile in alcuni siti del Mar Tirreno.» (PDF). Società Italiana Ecologia Atti 17. Consultado el 3 de octubre de 2007.
- ↑ Universitat de les Illes Balears. «Posidonia oceanica (L.) Delile». Herbario Virtual del Mediterráneo Occidental. Consultado el 26 de agosto de 2008.
- ↑ Green & Short (2003) op. cit., pág. 55.
- ↑ «Ibiza, Biodiversity and Culture - UNESCO World Heritage Centre».
- ↑ «El Govern lanza un teléfono y una 'app' de información cartográfica sobre las praderas de posidonia». Europa Press. 2 de junio de 2021. Consultado el 9 de diciembre de 2022.
- ↑ «Fondeig respectuós amb l'APP FanCat». Departament d'Acció Climàtica, Alimentació i Agenda Rural (en ca-ES). Consultado el 20 de octubre de 2021.
Bibliografía
[editar]- C. F. Boudouresque et al. (1984). International Workshop on Posidonia oceanica beds (en inglés). Marsella: GIS Posidonie publ. p. 454. ISBN 2-905540-00-1.
- C. F. Boudouresque; A. Meinesz (1982). Decouverte de l'herbier de Posidonie. GIS Posidonie. p. 80. OCLC 33452266.
- P. Carpentieri (21 de octubre de 2005). «Introduzione alla ecologia marina, parte 1 (Università di Roma "La Sapienza", Laurea Triennale in Scienze Naturali e Scienze Biologiche)» (PDF). Archivado desde el original el 12 de mayo de 2011. Consultado el 20 de septiembre de 2007.
P. Carpentieri (21 de octubre de 2005). «Introduzione alla ecologia marina, parte 2 (Università di Roma "La Sapienza", Laurea Triennale in Scienze Naturali e Scienze Biologiche)» (PDF). Archivado desde el original el 5 de julio de 2010. Consultado el 20 de septiembre de 2007.
- Caye, C.; Meisnez A. (1992). «Analyse des modalités de la multiplication végétative et de la reproduction sexuée de Posidonia oceanica et de ses conséguences sur la constitution génétique des herbiers». Rapp. Comm. Int. Mer Medit. 33: 32.
- Cinelli, F.; Pardi G.; Papi I. (diciembre de 2005). «Biologia della pianta». La Posidonia oceanica, supp. Rivista Marittima Italiana: 17-20.
- Den Hartog, C. (1970). The seagrasses of the world. Amsterdam: North Holland publishing company. pp. 273. OCLC 113494.
- Green, Edmund Peter; Frederick T. Short (2003). World Atlas of Seagrasses. University of California Press. pp. 48-57. ISBN 0-520-24047-2.
- Mazzella, L.; et al. (1987). Laboratorio di ecologia del benthos della Stazione zoologica Anton Dohrn di Napoli - Ischia, ed. Le praterie sommerse del Mediterraneo. Ercolano: La Buona Stampa S.p.a. p. 59. OCLC 38639215.
- Mazzella, L.; et al. (diciembre de 2005). «Organizzazione trófica nell'ecosistema a Posidonia». La Posidonia oceanica, supp. Rivista Marittima Italiana: 31-39.
- Melley, Antonio; Bertolotto Rosella; Gaino Federico; Intravaia Francesca; Sirchia Benedetto; Colomba Migliore Maria (octubre de 2005). «Allegato 3:Posidonia oceanica» (PDF). En Melley Antonio, ed. Indicatori biologici per le acque marine costiere. Agenzia per la Protezione dell'Ambiente e per i Servizi Tecnici - Centro Tematico Nazionale "Acque Interne e Marino Costiere". pp. 42-52. Archivado desde el original el 13 de mayo de 2006.
- Angelo Mojetta; Andrea Ghisotti (marzo de 2004). Flora e fauna del Mediterraneo (8ª edición edición). Milán: Mondadori. pp. 31-32, ficha 22. ISBN 88-04-38574-X.
- Moliner, R.; Picard, J. (1952). «Recherches sur les herbiers de Phanérogams marines du littoral méditerraneen français». Ann. Inst. Oceanogr. 27 (3): 157-234. ISSN 0078-9682.
- Pergent, G.; et al. (1995). «Utilisation de l'herbier a Posidonia oceanica comme indicateur biologique de la qualité du milieu littoral en Méditerranée: état des connaissances.» (PDF). Mésogée (en francés) 54: 3-27. ISSN 0398-2106. Archivado desde el original el 22 de noviembre de 2011. Consultado el 13 de octubre de 2007.
- «Angiosperme marine» (PDF). Consultado el 4 de octubre de 2007. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- «Flore électronique». Tela Botanica. Archivado desde el original el 5 de septiembre de 2009. Consultado el 11 de octubre de 2007.
- «Posidonia oceanica». Mare. Regione toscana - Ambiente e territorio. Archivado desde el original el 14 de agosto de 2007. Consultado el 4 de octubre de 2007.
Enlaces externos
[editar] Wikispecies tiene un artículo sobre Posidonia oceanica.
Wikispecies tiene un artículo sobre Posidonia oceanica. Wikimedia Commons alberga una categoría multimedia sobre Posidonia oceanica.
Wikimedia Commons alberga una categoría multimedia sobre Posidonia oceanica.- La Posidonia oceanica, fuente de vida - marenostrum.org
- Posidonia oceánica, la joya del Mediterráneo - greenpeace.org
- Posidonia oceánica y regeneración de playas - elmundo-eldia.com, 17 de marzo de 2002
- La Posidonia Oceánica - Club de la Mar
- Red de seguimiento de las praderas de Posidonia oceanica de la Región de Murcia 2006 - Servicio de Pesca y Acuicultura. Dirección General de Agricultura y Pesca. Comunidad Autónoma de la Región de Murcia.
- Mapa interactivo para visualizar la localización de las praderas de posidonia elaborado por el Gobierno de les Illes Balears.
- Aplicación Posidonia App del Gobierno de les Illes Balears.
- Aplicación Carry Map en la que se puede descargar y visualizar el mapa FanCAT elaborado por la Generalitat de Cataluña con la localización de las praderas de posidonia.
